
在氢能产业的技术图谱中,氢化镁(MgH2)以其卓越的储氢性能成为固态储氢领域的焦点。镁是地球上储量最丰富的轻合金元素之一,我国的镁储量十分丰富,居世界第二位。镁不仅具有价格低廉、密度低(1.8 g/cm³)、比强度高等优点,而且理论储氢容量高达7.6 wt%,是金属储氢材料中的佼佼者。
MgH2可以通过热解和水解两种方式来制备氢气:热解的放氢焓变较高(74.5 kJ/mol),表明需外部能量输入以驱动分解;水解不需要外部能量的输入,在常温下就能进行。
热解反应
高温下的可逆储氢循环
想要了解MgH2热解的机理,我们首先需要明白镁是如何“吸氢”的。Mg/MgH2的吸放氢过程需要发生Mg原子晶格的转变,并涉及H原子在其中的迁移,导致在热力学和动力学上吸放氢均较为困难。对Mg/MgH2材料吸氢和放氢机理的研究,主要将过程分为五步。
以吸氢过程为例: (1)H2分子运动到Mg晶体表面,并被表面原子吸附; (2)H2分子在Mg表面发生解离,H原子吸附在金属表面; (3)H原子从金属表面向内层渗透; (4)H原子在金属内部扩散并逐渐深入,此时还未形成有序的MgH2晶体结构,H和Mg以固溶体的形式存在,称为α相; (5)含氢量达到一定水平之后,α相固溶体发生相变,有序的MgH2结构产生,得到氢化晶态的β相。
而放氢过程则正好与此相反。
热解路径的核心优势在于系统循环效率。由于反应产物为金属镁,其可通过直接氢化再生,具有可逆性;且MgH2热解循环稳定性良好,储氢容量衰减率低。但MgH2热解也并非没有缺点,热解需要较高的温度,这是制约MgH2热解制氢发展的主要因素之一。通过加入催化剂等手段,可有效将脱氢温度降低。添加富德金煜二代催化剂的MgH2热解体系,可以将起始放氢温度从300℃骤降至220℃。
水解反应 常温产氢与钝化层博弈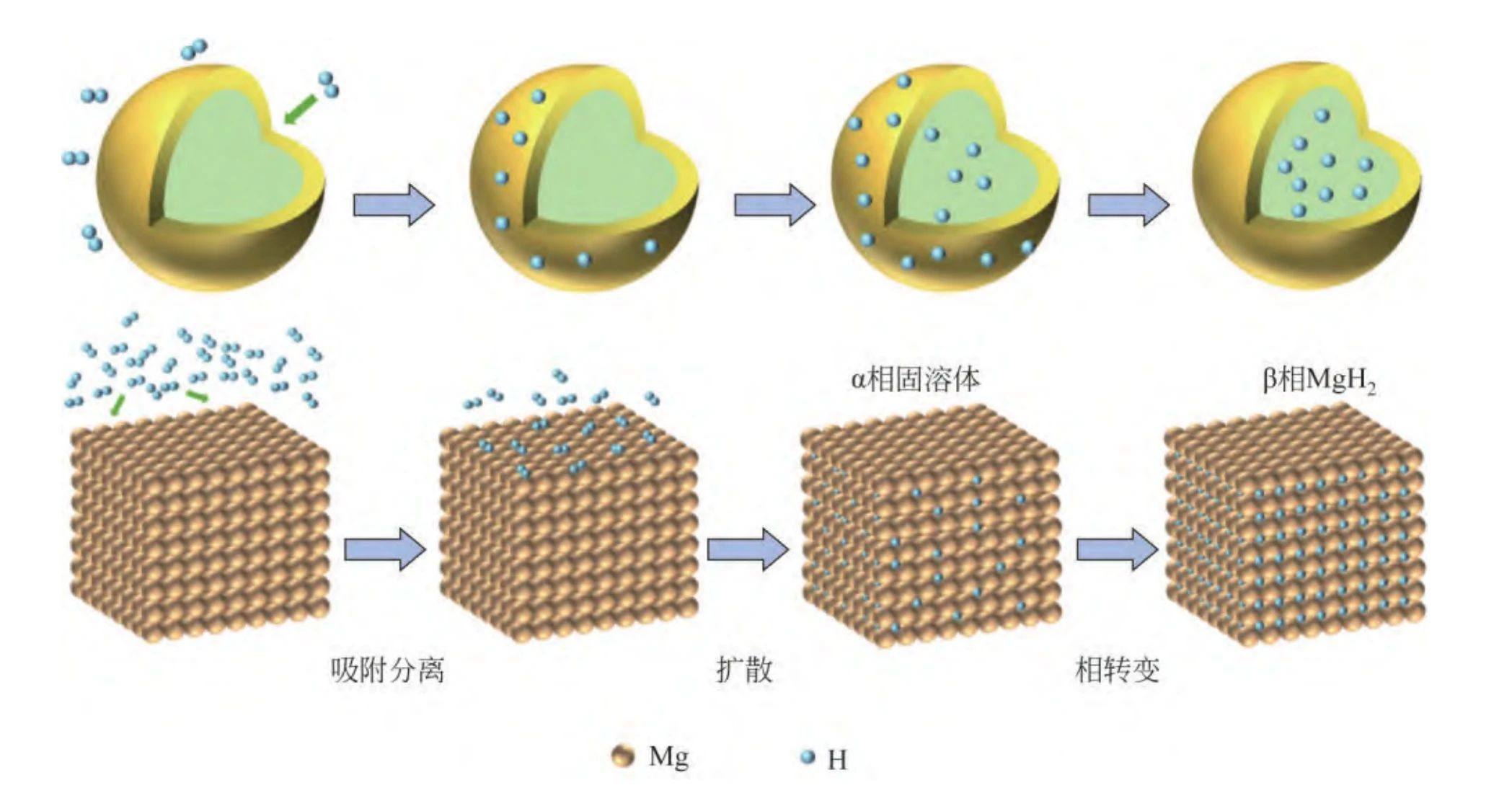
水解反应通过氢化镁与水的直接化学作用释放氢气,反应式为: MgH₂+2H₂O→Mg(OH)₂ +2H₂
此过程为不可逆放热反应,理论产氢量达15.2 wt%。其产氢过程分为两个阶段:第一阶段反应迅速,其控制环节为晶粒尺寸和比表面积;反应进入第二阶段时Mg(OH)2钝化层已经形成,反应速率较慢,其控制环节主要是水通过钝化层的扩散速率【1】。
图1 镁基材料水解反应示意图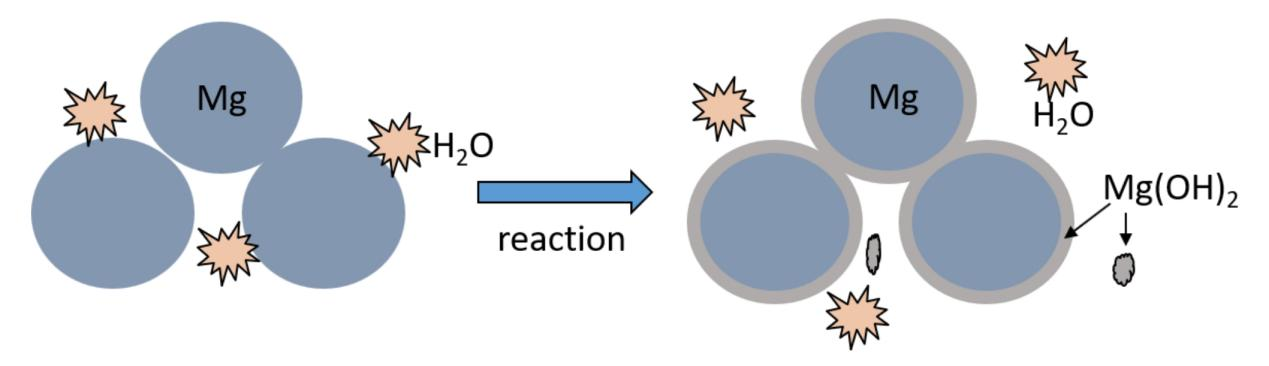
MgH2水解具有很高的放氢效率,无需外部热源,常温下即可快速产氢;副产物氢氧化镁无毒、易回收,可转化为工业原料,同时兼具成本低廉、产氢量高等优点,在制氢领域具有广阔的应用前景。但反应水解产物氢氧化镁沉淀极易附着在氢化镁颗粒表面,随着反应的进行,其表面形成致密钝化层,严重阻碍水解反应的进行【2】。
降低粉末尺寸、在溶液中添加酸盐、复合具有催化作用的第二相等被认为是改善水解性能的有效方法。概括起来主要分为以下四种途径【3】: (1)增加MgH2粉末的比表面积,增加反应位点; (2)添加酸性物质,比如酸或酸式盐腐蚀水解过程中形成的Mg(OH)₂层; (3)转移Mg(OH)₂的形成位置,使其不在Mg/MgH2粉末表面形成钝化层; (4)添加导电物质,构成原电池(要确保溶液的导电性)。
氢化镁的热解与水解反应代表了典型的氢释放策略。热解依赖高温与催化改性以实现可逆循环,水解通过界面调控突破钝化层限制。
未来研究可聚焦于:(1)持续开发高效催化剂以降低热解温度;(2)设计多级孔结构或动态界面以提升水解传质效率。这些方向将推动氢化镁驶向更广阔的应用领域,为氢能经济提供关键材料支撑。
引用来源: 【1】Effect of Mechanical Activation on the Reaction of Magnesium Hydride with Water 【2】Production of hydrogen from magnesium hydrides hydrolysis 【3】改善镁/氢化镁水解放氢性能研究进展
来源:富德金煜
